2016年4月11日,范衡宇教授实验室在国际著名学术期刊Nature Structural and Molecular Biology(《自然-结构与分子生物学》)上发表研究论文,报道了一个启动哺乳动物早期胚胎发育的关键母源因子,并揭示了“母体-胚胎转换”过程中母源性mRNA降解的分子机制。
“受精”是雌雄生殖细胞融合而产生新生命的过程,是个体发育的起点。成熟的卵母细胞中储备了大量用于调控减数分裂成熟和受精后早期胚胎快速发育所需的RNA和蛋白质。直到受精卵发育一段时间以后,母源性mRNA和蛋白质被消耗殆尽或者发生主动降解,胚胎基因组才被激活,发育程序才处于胚胎自身基因的调控之下。这个过程被称为“母体-胚胎转换”,是动物生命过程中经历的第一个重要发育事件。受精卵在幽深曲折的输卵管中一边蹀躞前行,一边卵裂,还要完成“母体-胚胎转换”,稍有不慎就会造成母子间两套遗传信息衔接不上,无法继续发育。因此,在人类辅助生殖和家畜胚胎工程操作过程中,如果培养条件不适合,或者胚胎质量不好,往往造成胚胎发育阻滞和早期流产。
卵母细胞成熟包括“细胞核成熟”和“细胞质成熟”两个方面。“细胞核成熟”的指标非常明确,就是完成第一次减数分裂、停滞在第二次减数分裂中期(以凝集的染色体整齐排列在纺锤体中部为标志),等待受精。而“细胞质成熟”的指标却模糊不清,但它又是现实存在的,因为有些卵母细胞虽然顺利发生了“细胞核成熟”,但却在受精以后裹足不前,发育失败。其原因就是卵细胞质中没有准备好必要的母源因子,帮助胚胎顺利完成“母体-胚胎转换”。这些决定“细胞质成熟”的母源因子是什么呢?目前我们只零星地知道其中几个,而远未窥见其全貌。
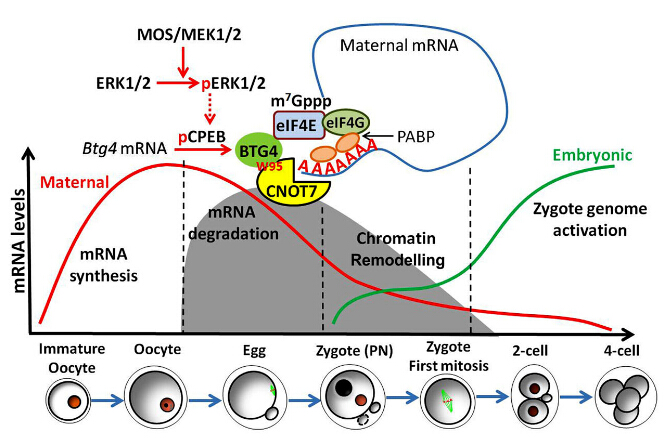
范衡宇课题组通过对卵母细胞和早期胚胎的转录组学研究发现,有一个叫做Btg4的基因特异性地表达在卵母细胞和受精卵中,而在所有已检测的其他细胞类型中都极不活跃。为了检验Btg4是否在“母体-胚胎转换”过程中发挥作用,课题组利用新型基因敲除技术,在小鼠基因组中敲除Btg4基因。结果发现,Btg4敲除的卵母细胞虽然能够正常成熟和受精,但是形成的早期胚胎却全部阻滞在1到2细胞阶段,造成雌性不育。这些胚胎停止发育原因是,母源性mRNA不能被及时降解,而许多对于早期胚胎发育至关重要的基因不能及时被表达出来。通过进一步的生化机理研究发现,BTG4蛋白起到一个媒介作用,把一种叫做CCR4-NOT的核酸去腺苷酸化酶复合体招募到正在活跃指导蛋白质合成的mRNA上,切割它们的多聚腺苷酸尾巴(poly-A tail),从而使这些mRNA变得极不稳定而利于降解。
更有意思的是,十几年以前科学家们就观察到,在卵巢中处于发育静止状态的卵母细胞中,母源性mRNA是相当稳定的,只有卵母细胞启动减数分裂成熟进程以后,母源性mRNA才变得极不稳定,但导致这一现象的分子机制一直不清楚。课题组在本研究中发现,虽然卵母细胞在生长过程中储存了丰富的Btg4 mRNA,但它在未成熟的卵母细胞中却不被翻译成蛋白质,从而保证那些储备的母源性mRNA能够保持稳定;只有当卵母细胞启动减数分裂成熟和排卵过程以后,BTG4蛋白才开始迅速积累,并诱导母源性mRNA降解。这种巧妙的调节机制是如何实现的呢?深入研究发现,只有当卵母细胞启动最终的成熟过程以后,两个重要的蛋白激酶ERK1和ERK2才被激活,它们进一步解除了Btg4 mRNA的翻译抑制状态,从而使母源性mRNA的降解与卵母细胞减数分裂和受精进程紧密地耦联在一起。
这个研究在若干方面都具有重要创新性意义:(1)找到了触发母体-胚胎转换、启动早期胚胎发育的新型母源因子BTG4;(2)阐明了蛋白激酶ERK1/2把“母体-胚胎转换”和减数分裂进程耦联在一起的分子机制;(3)利用生理实验模型证明了在哺乳动物生殖发育过程中,母源性mRNA降解是启动早期胚胎基因组激活的前提条件。
该项研究不但回答了上述生命科学领域悬而未解的重要理论问题,也为人类辅助生殖和动物胚胎工程技术的进一步改进提供了新的思路。北京大学生命科学学院汤富酬教授研究团队和中国科学院动物研究所孙青原研究员是该课题的合作完成者。
文章链接:http://www.nature.com/nsmb/journal/vaop/ncurrent/full/nsmb.3204.html




