基础的细胞实验
1.体外培养细胞一代生存期
Ø 分为游离期、贴壁期、潜伏期、对数生长期、停止期(平台期)。
Ø 对数生长期:细胞数随时间变化成倍增长,活力最佳,细胞数量呈指数增长,细胞群体均一。最适合进行实验研究。
Ø 细胞摇匀的经验:
孔越小,越要好好摇。种的时候可以有意识的分散种细胞,而不是直接一个小区域种下去。96孔板种细胞轻点打进孔里,打的太猛细胞容易聚集在边缘。六孔板手动8字晃匀效果比较好。种细胞时晃动细胞很重要,但应避免在桌子上推着前后左右晃。在手中两个方向的八字晃会更稳更好。
 2细胞计数
2细胞计数
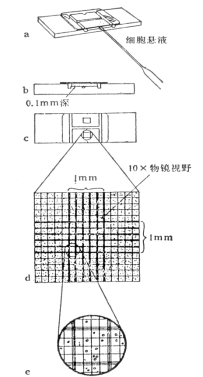
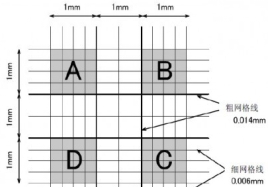
Ø 细胞悬液的细胞数/ml=(四个大格子细胞数/4) ×稀释倍数 ×104/ml
Ø 计数建议:
1) 压边线细胞:计上不计下,计左不计右;
2) 镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液;
3) 每个细胞悬液至少滴样两次求平均值。
Ø 提问:细胞计数的浓度控制在多少?计数重复几次?
答:建议浓度控制在50-100万/ml。建议表型实验计数4次,普通实验计数2次。建议全部计数完再一起种板。
Ø 注意点:细胞计数不要同时记超过4株以上的细胞。若有需要,先消化记4株,细胞浓度调好静置一边;再消化计另外的。而后按消化和计数顺序种细胞。这样可以避免多株细胞同时消化而带来的消化不理想。
3. 常用细胞培养器皿
4. 液氮是低温制品,在使用过程中要防止冻伤。在液氮中操作及存取冷冻物品时速度要快,要注意轻拿轻放,以免内容物解冻,造成不必要的损失。
5. 细胞传代
Ø 消化温度:室温或37℃。
Ø 消化时间:不超过10 min,也不可太短(须形成单细胞悬液)。
Ø 注意点:
1) 防止细胞成片滑落(4℃消化,延长消化时间较易获得单细胞悬液);
2) 轻柔吹打,防止机械损伤;
3) 离心时不超过300 g (1000 rpm),实验室目前离心所用转速为800rpm;
4) 尽量避免刮伤培养瓶细胞贴附面,否则影响观察且细胞贴壁不均匀;
5) 及时换液和传代,不可拖延,避免细胞过爆后细胞状态不好。
6. 细胞消化条件参考
Cell line | 胰酶 | 条件 | 时间 | 传代比例 | 长满时间 | 10cm dish细胞数 |
Huh1 | EPET | 37℃ | 4 min | 1:4 | 5d | 400w |
Huh7 | EPET | 37℃ | 2 min | 1:6 | 4d | 200w |
HLE | EPET | 37℃ | 3 min | 1:8 | 3d | 200w |
HLF | EPET | 37℃ | 3 min | 1:8 | 3d | 200w |
HepG2 | 0.25%Trypsin | 37℃ | 4 min | 1:3 | 5d | 200w |
Hep3B | 0.25%Trypsin | 37℃ | 1.5 min | 1:4 | 4d | - |
HUCCT1 | 0.25%Trypsin | 37℃ | 6 min | 1:10 | 3d | 500w |
RBE | EPET | 37℃ | 2 min | 1:10 | 3d | 200-300w |
Huh28 | 0.25%Trypsin | 37℃ | 6 min | 1:3 | 3d | 30w |
293T | 1/10 EPET | RT | 1 min | 1:20 | 3d | 1000w |
3T3 | EPET | 37℃ | 3 min | 1:8 | 3d | 400w |
LX2 | EPET | RT | 1 min | 1:3-1:4 | 2-3d | - |
THP1 | - | - | - | 1:4 | 3 | - |
7. 换液时机
1) pH降低。培养基颜色由红变橙要警惕,变成黄色前一定要换液。
pH降至6.5时,细胞停止生长。
pH降至6.0时,细胞失去活性。
2) 发现细胞出现形态衰退时须勤换液。
3) 细胞密度过低或生长缓慢,则更换一半培养基。
8. 细胞冻存(慢冻)
Ø 预先配制冻存液:10%DMSO +细胞生长液(50%血清+40%基础培养液)。
由于DMSO 稀释时会放出大量热能,故不可将DMSO直接加入细胞液中,必须使用前先行配制完成。
Ø 取对数生长期细胞,经胰酶消化后,加入适量冻存液, 用吸管吹打制成细胞悬液(1-5×106 cell/ml)
Ø 加1 ml细胞悬液于冻存管中,密封后标记冷冻细胞名称、冷冻日期、代数、细胞数量和实验者名字。液氮长期保存。
Ø 慢冻程序:
1) 标准程序:采用细胞冻存器。
当温度在-25℃以上时, 1~2 ℃/min
当温度达-25℃以下时, 5~10 ℃/min
当温度达-100℃时,可迅速放入液氮中
2) 传统程序:冷冻管置于4℃ 1 h→ -20℃ 1 h→ -80℃16-18 h(或隔夜) → 液氮槽长期储存。
9. 细胞的复苏方法(速融)
Ø 注意点:37℃水浴,快速解冻,避免慢速融化水分渗入细胞内,再次形成胞内结晶损伤细胞。
Ø 冻存细胞从液氮中取出后,立即放入37℃水浴中,轻轻摇动冷冻管,使其在1 min内(不要超过3 min)全部融化,5 min内用培养液稀释至原体积的10倍以上。
Ø 两种解冻后处理方法:
1) 解冻后的细胞直接接种到含完全生长培养液的细胞培养皿进行培养,24 h后更换培养液,以去除DMSO。
2) 解冻后的细胞先通过低速离心10 min去除冷冻保护剂,然后再接种到含完全生长培养液的培养皿中。
10. 荧光显微镜启动高压汞灯后,不得在30 min内将其关闭;关闭后,必须待汞灯冷却后方可再次打开。
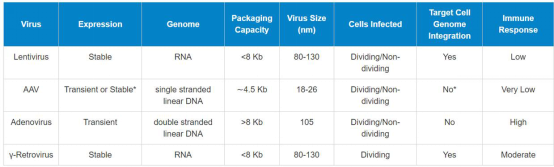
11. Lentivirus production in 293T cells
Using Lipofectamine 3000, Ji lab, 2019
1. The day before transfection (Day 1), passage1/3 10 cm dish 293T cells in a new 10cm dish so that they will be 70-80% confluent on the day of transfection.
2. On the day of transfection (Day 2), remove the culture medium from the 293T cells and replace with 6 ml of fresh medium (without antibiotics) containing serum.
3. For each transfection sample, prepare DNA-Lipoectamine™ 3000 complexes as follows:
l In a sterile 1.5 ml tube with 0.5ml Opti-MEM®, add:
Packaging Plasmid--psPAX2 (10703bp, addgene12260) 5.3ug
Envelope Plasmid---pMD2.G (5824bp, addgene12259) 1.4ug
or
Packaging Plasmid--pCMV-dR8.2 dvpr (13457bp, addgene8455) 6.6ug
Envelope Plasmid---pCMV-VSV-G (6363bp, addgene8454) 1.6ug
AND
Transfer Plasmid---Lenti-miR/miRZip-antimiR (SBI, 7.5/7.9kb) 5.3ug
Note:The proper molar ratio shall be Envelope Plasmid:Packaging Plasmid:Transfer Plasmid=1:2:3~4.
l Adding p3000. p3000 (volume): plasmid (ug) =2:1
l Mix gently, RT for 5 mins.
4. In a separate sterile 1.5 ml tube with 0.5ml Opti-MEM®, add: Lipofectamine™ 3000 20ul.
Mix gently, RT for 3-5 mins (Note: has to be less than 15mins)
5. After the incubation, combine the above diluted DNA with the diluted Lipofectamine™ 3000.
Mix gently. Incubate, RT for 20 minutes.
6. Add the DNA-Lipofectamine™3000 complexes to each dish of cells. Mix gently by rocking the plate back and forth.
7. After 24 hours post transfection (Day 3), add 8 ml fresh medium (without antibiotics) containing serum. Incubate at 37°C in a humidified 5% CO2 incubator.
8. Harvest virus-containing supernatants 52hours posttransfection (Day 4) by removing medium into to a 15 ml sterile tube, keep on ice.
9. Centrifuge supernatants at 2000 rpm for 10 minutes at +4°C to pellet debris.
10. Filter the viral supernatants through a 0.45 µm filter.
11. Aliquot viral supernatants into 1.5 ml tubes (0.5ml/tube). Store viral stocks at -80°C.
12. Proceed to Titer Your Viral Stock.
Note: If use lipo 2000, no need add p3000. If use PEI 40,000, PEI: plasmid=1.875: 1
12. Titer LentiVirus
Viacounting GFPcells, Ji lab, 2016
1. The day before transduction (Day 1), trypsinize and count the 3T3 cells, plating 3000 cells/well of 96-well plate. Incubate cells at 37°C overnight in a humidified 5% CO2 incubator.
2. On the day of transduction (Day 2), thaw your Lentiviral stock and prepare 10-fold serial dilutions ranging from 10-1 to 10-8. For each dilution, dilute the Lentiviral stock into complete culture medium to a final volume of 0.15 ml. DO NOT vortex, But mix well.
l Using 96-well plate to do the dilution and tittering.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
A | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
B | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
C | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
D | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
E | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
F | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
G | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
H | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
l Column #1-#6 is used for dilution.
l Add 135 ul of culture medium to each dilution well.
l Line A: add 15 ul virus from original lentivirus stock. Mix well
l Line B: add 15 ul virus from the well of line A. Mix well
l Line C: add 15 ul virus from the well of line B. Mix well
l ……
l So, line A is 10× dilution; line B is 100× dilution.
3. Remove the culture medium from the cells. Mix each dilution gently by pipetting and add 0.1 ml to one well of cells (total volume = 0.1 ml).
4. Add Polybrene® to each well to a final concentration of 8 µg/ml.
5. Swirl the plate gently to mix. Incubate at 37°C overnight in a humidified 5% CO2 incubator.
6. The following day (Day 3), remove the media containing virus and replace with 0.1 ml of complete culture medium. Incubate at 37°C overnight in a humidified 5% CO2 incubator.
7. Incubate cells for an additional 3 days. Analyze the percentage of GFP-positive cells.
8. Calculate the titer (TU/ml) by with the formula:
Titer = # of positive clones / 0.1ml × times of dilution
13腺相关病毒(
腺相关病毒属微小病毒科(parvovirus),为无包膜的单链线状 DNA 病毒。AAV 的基因组约4700bp,包括上下游两个开放读码框架(ORF),位于分别由 145 个核苷酸组成的2 个反向末端重复序列(ITR)之间。 基因组中有 3 个启动子(P5、P19 和 P40) 和 2 个开放阅读读框(ORF),rep 和 cap,如图所示。rep 编码 4 个重叠的多功能蛋白,即 Rep78、Rep68、Rep52 和 Rep40,其中 Rep78 与 Rep68 参与 AAV 的复制与整合,Rep52 和 Rep40 具有解螺旋酶和 ATP 酶活性,与 Rep78、Rep68 共同参与单链基因组的复制;cap 编码的 VP1、 VP2、VP3是装配成完整病毒所需要的衣壳蛋白,它们在 AAV 病毒整合、复制和装配中其重要作用。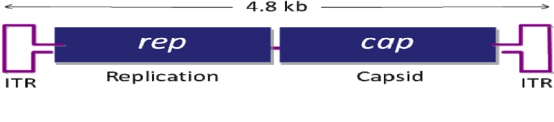 From腺相关病毒操作手册
From腺相关病毒操作手册
14重组腺相关病毒载体系统简介
AAV是一种复制缺陷型微小病毒,其增殖复制需要腺病毒或疱疹病毒的辅助。
AAV无辅助病毒系统(AAV Helper-Free System),可以在无辅助病毒的条件下生产出重组腺相关病毒。生产具有感染性的AAV 病毒颗粒所需的腺病毒基因产物(如:E2A,E4 等基因)大部分由pHelper 质粒提供。 腺病毒基因产物由稳定表达腺病毒E1基因的AAV-293宿主细胞提供。AAV-293细胞是HEK293细胞经过改良腺相关病毒生产能力而衍生出的亚克隆细胞系。 rep和cap基因从病毒载体中被转移到辅助质粒pAAV-RC 中,AAV ITRs 仍位于病毒载体中。在辅助质粒的帮助下,仅需两端的ITR就能将携带的外源片段包装进入腺相关病毒颗粒。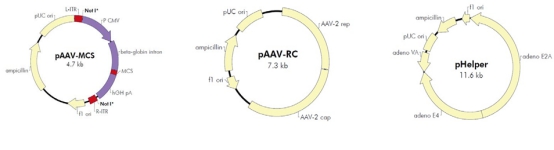
Ø AAV可以特异地只感染肝脏或者其他器官,不同血清型AAV对不同组织亲和度不同,如AAV8对肝脏组织亲和度最高。
Ø AAV不整合在基因组上,降解较慢,大约能在体内保持6个月以上,一般不需要重复给AAV,根据实验具体考虑。
Ø AAV最长可插入片段参考: