构建克隆
内容:质粒构建,是指在大肠杆菌中将目的DNA分子片段与特定载体的DNA分子连接而产生重组质粒的方法。但仅仅插入质粒是不够的,还需要把质粒转化到细菌、细胞或酵母中,使质粒在其中扩展或表达。现已发展出多种分子克隆技术,如传统的质粒重组技术、LIC技术、SLIC技术、Gibson组装,Gateway技术等。
目的:把特定的基因序列插入到工程质粒中。构建成功后可以进行下一步研究,如该基因对宿主的影响等。
常用的构建克隆方法:
l 传统的质粒重组技术(酶切连接)
1. 原理
传统意义上,质粒重组是基于碱基互补配对的原理,一般做法为:通过引物在目的片段两端引入酶切位点;用相同的限制性内切酶分别对目的片段和载体进行酶切处理;目的片段和载体的酶切产物在体外连接;连接产物转化大肠杆菌;筛选重组子。
2. 步骤
在高表达目的基因的细胞中提取RNA,反转录为cDNA模板,或者通过该基因的cDNA文库,设计带有酶切位点的目的基因引物,进行PCR,电泳,胶回收;酶切,电泳,胶回收,连接,涂板,挑单克隆验证,测序。一般测序节约时间的做法是:先测一个反应,如果正确,然后两个方向一起测,再拼接起来,缩短等待时间。
Note:
1) 每一步都需要根据该目的基因与载体的特性调整实验;
2) 考虑到后续实验,在选择载体时务必要满足与宿主细胞兼容且容易检出的条件;
3) 选择酶切位点时注意两个酶切位点是否会互补,尤其是一些小众的酶切位点;
4) 双酶切的时候要注意Buffer的选择,两个酶的用量也要调整,可利用网址https://www.thermofisher.com/cn/zh/home/brands/thermo-scientific/molecular-biology/thermo-scientific-restriction-modifying-enzymes/restriction-enzymes-thermo-scientific/double-digest-calculator-thermo-scientific.html调整该公司的双酶切体系;
5) 酶切、回收后的PCR产物与载体连接,摩尔比的计算,回收的载体片段:回收的PCR产物片段=1:1—1:5。
l Gateway技术
1. 原理
Gateway技术是基于已研究的非常清楚的λ噬菌体位点特异重组系统(attB x attP →attL x attR),将目的DNA快速克隆到各种与Gateway技术兼容的目的载体上,不需要进行酶切和连接反应。BP和LR两个反应就构成了Gateway技术。BP反应是利用一个attB DNA片段或表达克隆和一个attP供体载体之间的重组反应,创建一个入门克隆。LR反应是一个attL入门克隆和一个attR目的载体之间的重组反应。LR反应用来在平行的反应中转移目的序列到一个或更多个目的载体。在BP反应中基因转移形成入门克隆,在LR反应中入门克隆可以作为反应物产生最终的表达克隆。
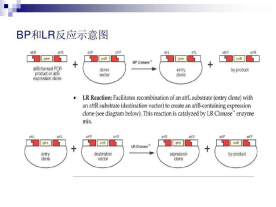
2. 步骤
(1)创建入门克隆,通过PCR或传统的克隆方法将目的基因克隆进入门载体。有几种方法可以构建Gateway入门克隆。无论选择何种方法,创建的入门克隆都是准备用来与各种目的载体进行重组,如PCR克隆(定向TOPO克隆至入门载体或与供载体B×P重组);限制性内切酶消化和连接进入入门载体;使用pCMV•SPORT6或pEXP-AD502;Gateway改造过的克隆资源。
(2)混合包含目的基因的入门克隆和合适的目的载体以及Gateway LR Clonase酶,构建表达克隆。(表达克隆用来在合适的宿主中进行蛋白的表达和分析。)
Note:具体体系见试剂盒说明书。

l LIC技术
1. 原理
Ligation-Independent cloning,简称LIC。采用LIC方法的pET载体是线性化的,在末端有12-15个突出的碱基以在退火时和目的片断互补。在设计PCR扩增引物时加入与LIC载体互补的序列,PCR产物用3’→5’的内切酶消化出单链与载体互补的序列。通过这种方式就可以把目的片断定向、高效地插入LIC载体上。一般的pET载体是先在不含DE3片段的菌株中进行克隆筛选,之后再把阳性克隆转化进入表达菌株,如BL21(DE3)中,通过IPTG诱导进行表达。而pETcoco载体它引入了低拷贝控制元件,F附加体上的oriS和repE元件与parABC共同作用下使质粒在细菌中保持单拷贝,这样即可以使质粒在细菌内稳定存在又可以减少外源蛋白对细胞的毒害作用。当我们需要大量表达时加入树胶醛醣诱导trfA基因表达,质粒在细胞内的拷贝数就可以增加到25-50。pETcoco载体同时兼容了DE3调控模型,在加入IPTG后诱导表达量达升高2500倍。
2. 步骤
具体做法为:设计PCR扩增引物,其中目的DNA分子引物5’端12个碱基不含有dCMP,线性载体末端的5’端12个碱基不含有dGMP;利用T4DNA聚合酶的3’-5’外切酶活性分别处理待插入的目的DNA片段和线性化载体,使其5’端分别产生粘性末端;目的DNA分子和线性化载体退火反应;转化大肠杆菌;重组子筛选。同传统质粒重组方法一样,LIC技术也是基于碱基互补配对的原理,“酶切”( 外切酶反应)和“连接”反应同样是分步进行。
l SLIC技术
1. 原理
SLIC技术是后续研究者在LIC技术的基础上,摒弃碱基互补配对的原则而建立的不依赖于序列和连接的克隆方法。
2. 步骤
设计目的DNA分子的PCR扩增引物,引物两端加上与载体同源的20~30bp的DNA片段;载体质粒线性化处理暴露出同源序列;转化大肠杆菌;重组子筛选。同传统质粒重组方法一样,该技术的“酶切”( 限制性内切酶反应)和“连接”( 同源重组)过程也是分步进行。
l Gibson技术
1. 原理
Gibson组装最早由Daniel及其同事于2009年提出,该技术适于拼接多个线性DNA片段以及进行载体组装,mastermix含有三种不同类型的酶:一种外切酶,从5’端开始对DNA进行消化,产生长的黏性末端,这样便于与另外的同源末端进行配对结合;一种聚合酶,用于修补碱基的缺口;一种DNA连接酶,实现无痕拼接,形成完整的DNA分子。从作用原理上来看,Gibson组装同样延续了传统质粒重组的碱基互补配对原则,只不过是互补序列进一步加长;该反应既需要限制性内切酶也需要限制性外切酶作用,且“酶切”(外切酶)和“连接”反应在同一个体系中完成,反应时间更短,效率更高。
2. 步骤
具体做法是:通过PCR引物在DNA分子末端加上同源片段;将DNA片段以及线性化载体在mastermix(混合酶体系)作用下孵育1h;转化大肠杆菌;重组子筛选。
感受态的选择
感受态细胞是指利用理化方法诱导细胞,使其处于最适摄取和容纳外来DNA的生理状态。实验者根据后续实验需求,针对不同感受态的特性和用途选择需要的感受态细胞。
一般常见的感受态如下。
感受态名称 | 特点 | 用途 |
DH5α | 一种常用于质粒克隆的菌株。 其Φ80dlacZΔM15基因的表达产物与pUC载体编码的β-半乳糖苷酶氨基端实现α互补,可用于蓝白斑筛选。recA1和 endA1的突变有利于克隆DNA的稳定和高纯度质粒DNA的提取。 | 分子克隆、质粒提取和蛋白质表达。 |
JM109 | 部分抗性缺陷,适合重复基因表达, 可用于M13克隆序列测定和蓝白斑筛选。 | 分子克隆、质粒提取和蛋白质表达。 |
BL21(DE3) | 该菌株用于以T7 RNA聚合酶为表达系统的高效外源基因的蛋白表达宿主。T7噬菌体RNA聚合酶基因的表达受控于λ噬菌体DE3区的lacUV5启动子,该区整合于BL21的染色体上。该菌适合于非毒性蛋白的表达。 | 蛋白质表达。 |
BL21(DE3)plysS | 该菌株带有pLysS,具有氯霉素抗性。此质粒还有表达T7溶菌酶的基因,T7溶菌酶能够降低目的基因的背景表达水平,但不干扰IPTG诱导的表达。 适合于毒性蛋白和非毒性蛋白的表达。 | 蛋白质表达。 |
BL21 StarTM (DE3) | 来源于BL21(DE3)菌株,含有rne131基因突变体,rne131突变基因能够增强菌株细胞内mRNA的稳定性,从而提高蛋白表达能力。主要适用于T7启动子表达载体(如pET系列)的高水平蛋白表达。JKBioHigh5TM系列BL21 Star(DE3)感受态细胞由特殊工艺制作,经pUC19质粒检测转化效率达108cfu/μg。 | 异源基因表达。 |
RosettaTM 2 Competent Cells | Rosetta2来源于Rosetta,本菌株含有pRARE2质粒,除了能够提供原Rosetta(DE3)宿主菌含有 的AUA, AGG, AGA, CUA, CCC, 和GGA六个稀有密码子的tRNA外,还提供了第七个稀有密码子CGG的tRNA。同时,pRARE2质粒具有氯霉素抗性。 Rosetta2载体通过提供稀有密码子,使得该宿主菌相对于其他大肠杆菌,能够提供更加“通用”的蛋白质表达,从而提升目的蛋白表达水平。 | 用于真核蛋白表达(表达稀有密码子) |
Note: Ji-lab现有的感受态有DH5α,BL21(DE3),rosetta, STBL2/3用于病毒载体,pLX304、PT3-EF1A-GW等gateway目的载体都要用DB3.1转化。
转化摇菌
1. 目的:将重组载体转入感受态细胞中,筛选重组子并大量扩增。
2. 注意事项:不同重组子细胞的培养条件不同(温度,转速等),如含有pENTR221载体的DH5α菌需要37℃和225转摇12-16h,含有pLX304的DH5α菌需要30℃和180/200转摇18-20h;确保无菌条件。质粒扩增培养基选择:对于量少且单一的液体操作简单快捷,而对于像文库扩增多种质粒同时扩增的时候,需要用固体培养基。
质粒运输与保存
质粒的运输国际上普遍采用点膜邮寄:在滤纸(最好灭菌)上用铅笔画一直径0.2cm-0.4cm圈,将一定体积的质粒点在圈内(比如10ul),自然风干后置于自封袋中即可寄样;收到样品后,将画圈的滤纸剪下,置于管中,加一定量的TE或双蒸水溶解(原则:够覆盖整个滤纸并最终能从中吸出10-20ul液体的量就行),溶解30分钟后取出溶液。之后进行转化摇菌。
质粒长期保存应在-20℃,短期保存于4℃。引物在4℃放久了,会不均质,用之前建议多涡旋一会,不然PCR容易出问题。
菌种运输与保存
一般菌种的保存形态是甘油菌,冻存在-80℃冰箱。但甘油保存菌容易污染,运输也不方便,因此,提倡寄送穿刺培养菌。因为穿刺菌在4℃下可保存数个月,并且不容易污染,便于运送。(注:夏天运输时一定要用冰盒冰袋)
制备甘油菌时,从菌种平板挑取单菌落,接种至液体培养基(按需要加入抗生素)中,培养过夜或培养至对数中期,取适量菌液于小管中,加入终浓度为10%-20%的灭菌甘油,混匀后可直接置于-80℃保存。
制作穿刺菌时,可在1.5ml的Tube管中加入琼脂培养基(半固体),把菌体用牙签穿刺于琼脂培养基中,37℃ 培养一个晚上后便可使用。收到寄送的穿刺菌后,如短期保存(1个月内),可直接置于4℃保存;如长期保存,建议从穿刺菌划线后,挑取单菌落,接种在液体培养基中,做成甘油菌,置于-80℃保存。如需备份,也需要重新制备甘油菌,-80℃保存。
附件:![]() 6.构建克隆实验.doc
6.构建克隆实验.doc




